Program dizajniran da pruža potporu onima koji primaju lijek IDACIO®▼(adalimumab) i njihovim zdravstvenim djelatnicima.
Kliknite ovdje i registrirajte se za neograničen pristup web-stranici.
Stranica je dostupna svim zdravstvenim djelatnicima.
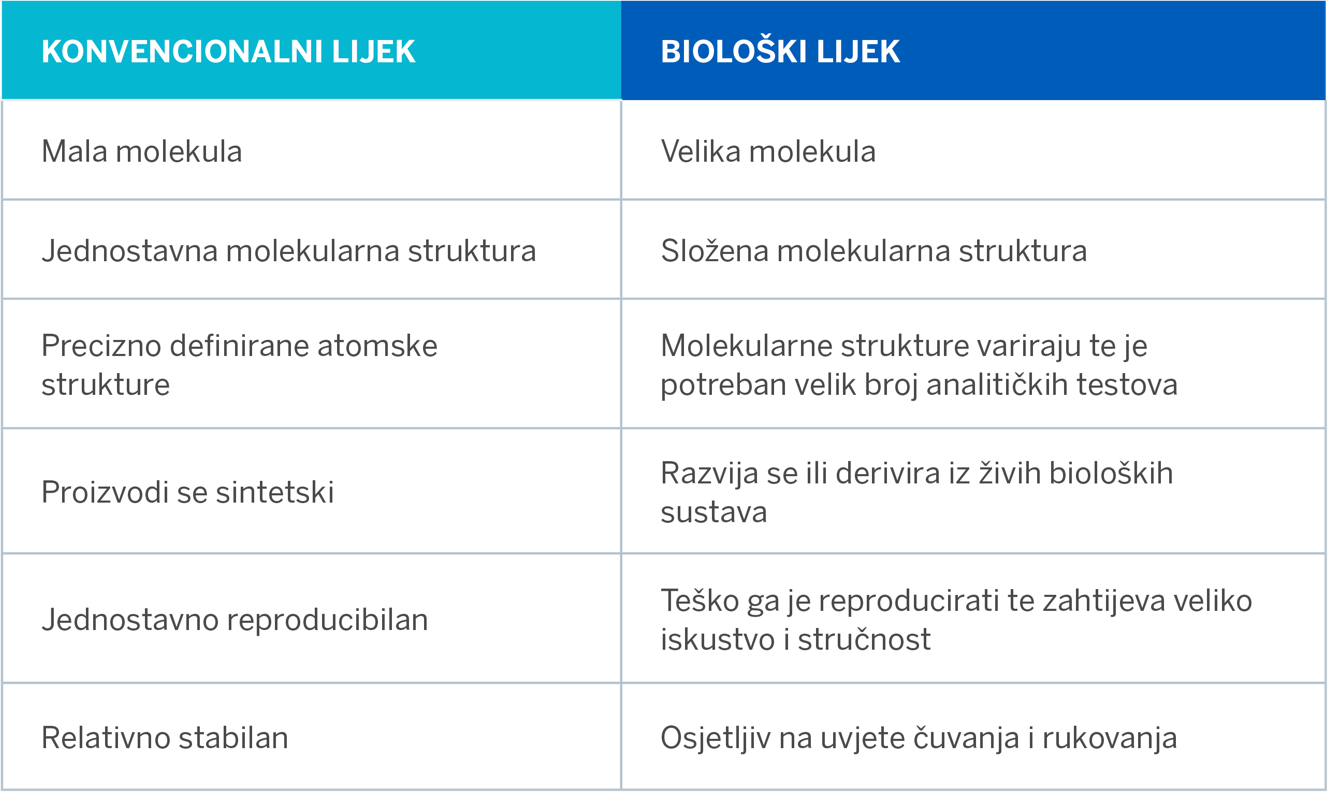
Biološki lijekovi revolucionizirali su liječenje mnogih kroničnih i po život opasnih bolesti.1 Biološki su lijekovi prema definiciji proteini velikih, kompleksnih molekula, razvijeni ili derivirani iz živih bioloških sustava, a koji zahvaljujući svojoj jedinstvenoj naravi koriste suvremenu rekombinantnu biotehnologiju.1
U donjoj tablici sažete su razlike između konvencionalnog lijeka (npr. acetilsalicilne kiseline) i biološkog lijeka (npr. adalimumaba).1,2,3
Europska agencija za lijekove definira biosličan lijek kao „lijek koji je visoko sličan s drugim biološkim lijekom koji se već nalazi u prometu u Europskom ekonomskom prostoru (takozvanom „referentnom lijeku“)“.4 Bioslični lijekovi nisu isto što i generički lijekovi.4 Generički lijek je identičan ili bioekvivalentan referentnom lijeku u svim aspektima, odnosno kvaliteti i karakteristikama učinka, zato što se proizvodi kemijskom sintezom.4 Biosličan lijek je vrlo sličan referentom lijeku, ali ne i identičan, jer se proizvodi u živim stanicama.4 Međutim, nema klinički značajnih razlika u djelotvornosti i sigurnosti u odnosu na referentni lijek.4
Farmaceutske tvrtke nakon nekoliko godina mogu razvijati i stavljati u promet bioslične lijekove.4 Zdravstveni sustavi sve su više skloni upotrebi biosličnih lijekova za koje su dokazani ekvivalentna klinička djelotvornost i sigurnosni profil kao i za referentni lijek.4 Bioslični lijekovi mogu zdravstvenim sustavima omogućiti uštedu troškova, pa tako veći broj suvremenih terapija može postati dostupan većem broju bolesnika.4
Bioslični lijekovi prolaze rigorozna ispitivanja i moraju dokazati da su slični referentnom lijeku u tri različite vrste ispitivanja:4
Komparativna ispitivanja kvalitete: in vitro ispitivanja uspoređuju strukturu i biološku funkciju proteina između biosličnog i referentnog lijeka.
Komparativna neklinička ispitivanja: uključuju farmakodinamička ispitivanja (u pravilu in vitro) kojima se uspoređuju biosličan i referentni lijek. U nekim slučajevima potrebna su in vivo toksikološka ispitivanja.
Komparativna klinička ispitivanja: klinička ispitivanja namijenjena su za potvrdu biosličnosti, a uključuju ispitivanja s fokusom na toksikologiju, farmakokinetiku i farmakodinamiku u zdravih dobrovoljnih ispitanika. Nakon toga slijede ispitivanja u barem jednoj osjetljivoj indikaciji (senzitivna indikacija) u kojoj se dokazuje usporediva učinkovitost, sigurnost i imunogenost biosličnog lijeka u usporedbi s referentnim lijekom.
Regulatorne smjernice za odobrenje biosličnih lijekova dopuštaju ekstrapolaciju indikacija.4 Ekstrapolacijom se dostupni podaci u jednoj indikaciji mogu upotrijebiti za odobrenje biosličnog lijeka i u ostalim indikacijama koje ima referentni lijek.4
Sigurnost je ključna komponenta za odobrenje novog biosličnog lijeka za koji mora biti dokazano da nema klinički značajnih razlika u imunosnom odgovoru u usporedbi s referentnim lijekom. Imunosni odgovori mogu utjecati i na sigurnost i na učinkovitost lijeka. U nekim slučajevima može biti potrebno posebno ispitivanje imunogenosti.
Bioslični lijekovi odobravaju se kao usporedivi lijekovi referentnom biološkom lijeku bez klinički značajnih razlika među njima. Na temelju toga, pod vodstvom liječnika i uz pozorno praćenje, bolesnik može prijeći s referentnog lijeka na biosličan lijek. Postoji rastući broj kliničkih dokaza da prelazak s referentnog lijeka na biosličan lijek ne utječe na ishode djelotvornosti i sigurnosti.
Za neograničen pristup sadržaju web-stranica, kliknite ovdje. Sadržaj je dostupan samo zdravstvenim djelatnicima.
1. Abraham J. Developing oncology biosimilars: An essential approach for the future. Semin Oncol 2013;40(Suppl1):S5-S24
2. Kozlowski S, Woodcock J, Midthun K, Sherman RB. Developing the Nation’s Biosimilar Program. N Engl J Med 2011;365:385-388
3. European Generics Medicines Association (EGA) Biosimilar Medicines Handbook. 2016 [online]. Dostupno na: http://www.medicinesforeurope.com/wp-content/uploads/2016/04/BIOSIMILAR-MEDICINES-HANDBOOK_INT_web_links2.pdf [pristupljeno Travanj 2020]
4. Biosimilars in the EU. Information guide for healthcare professionals. European Medicines Agency. Dostupno na: https://www.ema.europa.eu/documents/leaflet/biosimilars-eu-information-guide-healthcare-professionals_en.pdf [pristupljeno Travanj 2020]
5. Cohen HP, Blauvelt A, Rifkin RM, Danese S, Gokhale SB, Woollett G. Switching reference medicines to biosimilars: A systematic literature review of clinical outcomes. Drugs. 2018 Mar;78(4):463-478.
Ako ste registrirani, koristite polje za prijavu
Napuštate web-stranice KabiCare. Imajte na umu da nismo povezani i nemamo kontrolu nad sadržajem na vanjskim web-stranicama trećih osoba.
Dalje